
La evidencia clínica obtenida a partir de estudios realizados en hermanos sugiere que la intervención temprana ofrece múltiples oportunidades para mejorar los resultados en pacientes a través de un tratamiento específico de la enfermedad y el inicio temprano de TRE, si se encuentra disponible.1-6
Se ha demostrado que la TRE, independientemente del momento del inicio, mejora los parámetros clínicos claves tale como mediciones de resistencia y pulmonares, que son críticas para la calidad de vida, el mantenimiento de la ambulación y las actividades de la vida diaria.7,8
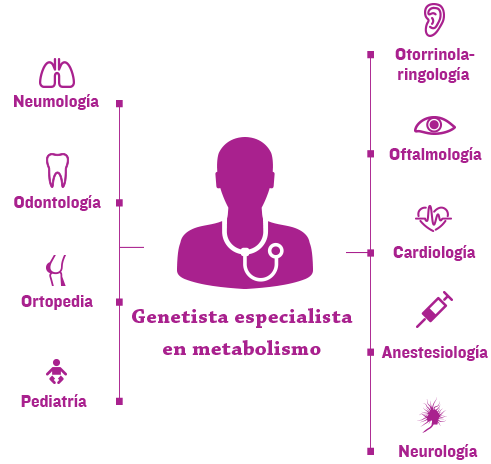
La nueva era de cuidado de enfermedades genéticas, complejas y progresivas, tales como las mucopolisacaridosis (MPS), depende de la coordinación eficiente del equipo de salud de cada paciente en centros de referencia1
Normalmente los genetistas y/o especialistas del metabolismo se encuentran en los centros y ayudan a coordinar la atención multidisciplinaria y un plan de tratamiento personalizado.2,3
Debido a la manifestación prácticamente universal de síntomas musculoesqueléticos en pacientes con MPS, los ortopedistas son miembros esenciales del equipo médico multidisciplinario.4

Muchas MPS cuentan con lineamientos de atención disponibles y recomendaciones consensuadas específicas de la especialidad con respecto a la atención de por vida de MPS. Generalmente, los lineamientos recomiendan3,7:
Las evaluaciones tempranas y periódicas de un equipo de salud coordinado pueden mejorar los resultados de los pacientes y pueden ayudar a prevenir daños irreversibles.7
Se debe evaluar y monitorear las siguientes manifestaciones musculoesqueléticas comunes8,9:
En todos los tipos de MPS se observan manifestaciones musculoesqueléticas similares; de hecho, son otras las manifestaciones clínicas que normalmente diferencian los subtipos de MPS entre sí. Sin embargo, se observan algunas diferencias notorias8:
A continuación se describen características musculoesqueléticas comunes de MPS por subtipo.
Las complicaciones esqueléticas son universales en todas las MPS, a pesar que la progresión de dichas complicaciones varía entre los pacientes. La prevalencia de manifestaciones ortopédicas específicas en todos los subtipos es variable, tal como se muestra en la tabla a continuación.
Los lineamientos incluyen las siguientes recomendaciones generales3,11:
A continuación podemos encontrar un plan de evaluación por imágenes más completo.
Tanto la evaluación inicial como las evaluaciones periódicas deben ser utilizadas para monitorear la progresión de la enfermedad musculoesquelética, determinar si es necesaria alguna intervención quirúrgica y cuando realizarla, y dar instrucciones con respecto a la mayor frecuencia de las evaluaciones. El monitoreo de la compresión de médula espinal es especialmente importante.3,5
La compresión de médula espinal es común en ciertos tipos de MPS—especialmente en Morquio A y MPS VI—e implica un riesgo de mortalidad significativo en estas poblaciones de pacientes.12
El ejemplo anterior está relacionado con Morquio A y es similar a las consideraciones descritas para las MPS. Los objetivos de las imágenes del eje neural en Morquio A son los siguientes12:
Los pacientes con MPS poseen un alto riesgo de complicaciones de la anestesia y sedación del procedimiento. En lo posible, se debe evitar la anestesia general y en caso de ser necesaria, debe ser administrada sólo por un anestesiólogo idóneo.12,13
Cabe destacar que la terapia de reemplazo enzimático (TRE) puede generar un impacto positivo sobre la movilidad y la resistencia, lo que puede reducir el umbral de cirugía ortopédica para facilitar un estilo de vida más activo.3
La frecuencia de las evaluaciones y participación de especialistas específicos varía según los distintos tipos de MPS. En pacientes con MPS asociadas con complicaciones primarias neurodegenerativas y cognitivas, tales como MPS I, II, y III, se recomiendan evaluaciones psiquiátricas y de comportamiento neurológico adicionales.7,14,15
Además de las evaluaciones específicas de la especialidad que deben realizarse para favorecer resultados positivos a largo plazo en pacientes con MPS, el médico coordinador, normalmente el genetista y/o especialista del metabolismo, puede realizar algunas acciones importantes con relación a la salud en general. Su rol en educar a otros profesionales de la salud (ej. dentistas, fisioterapeutas, pediatras, médicos de familia) y a las familias sobre la enfermedad y las estrategias generales de cuidado es crítico y debe incluir lo siguiente:
Tanto las evaluaciones específicas de la enfermedad como los exámenes físicos e intervenciones generales de salud deben seguir los lineamientos recomendados, que pueden variar según el subtipo de MPS.3
Los avances en el tratamiento de enfermedades MPS favorecen los resultados a largo plazo en pacientes, por lo que se necesitan nuevos enfoques de atención de por vida.
Con el paso de los años, algunos pacientes aprenden a manejar su propio salud, y esto hace que la transición del cuidado del médico al escenario adulto sea crítica.3 Los médicos deben asegurar lo siguiente:
La transición de la atención pediátrica a la adulta y la atención a largo plazo son áreas fundamentales a tener en cuenta en los planes de atención de pacientes adolescentes y adultos.3 Las consideraciones a largo plazo son mejor abordadas en un centro con amplia experiencia en MPS, y requieren una coordinación minuciosa entre las especialidades.3,17 Las cuestiones a largo plazo incluyen, pero no se limitan a las siguientes:
La atención a largo plazo de enfermedades MPS—incluyendo evaluaciones continuas y estrategia de transición específica del centro desde la atención pediátrica hasta la adulta— puede llevar a una mejora considerable en la calidad de vida y a un mejor futuro para los pacientes.3,17-19
Debido a que las manifestaciones clínicas de enfermedades mucopolisacaridosis (MPS) son multisistémicas, se requiere un enfoque multidisciplinario, específico del paciente, para reconocer y manejar las complicaciones de manera proactiva, tales como cirugías ortopédicas que son frecuentes en pacientes con MPS.1,2
Los pacientes con enfermedades MPS normalmente atraviesan una cantidad de cirugías durante sus vidas. Un estudio de evolución natural que evaluó un cohorte de 325 pacientes con Morquio A (MPS IVA) halló que más del 70% de los pacientes había sido sometido por lo menos a una cirugía.3

Los pacientes con MPS tienen una tasa alta de mortalidad perioperatoria debido a múltiples factores, incluyendo la obstrucción de las vías superiores e inferiores, inestabilidad cervical espinal, insuficiencia respiratoria, morbidez cardiovascular, e infecciones frecuentes .1,3,4 Por ejemplo, las complicaciones quirúrgicas resultaron en una tasa de mortalidad del 11% en pacientes con Morquio A (n=27).5
Es fundamental crear un plan quirúrgico que involucre a un equipo multidisciplinario de especialistas que también tenga experiencia, preferentemente, en el manejo de pacientes con MPS.4
La preparación para el riesgo quirúrgico y de la anestesia en pacientes con MPS requiere un equipo de atención experimentado, multidisciplinario, formado por un anestesiólogo, cardiólogo, neumonólogo y otorrinolaringólogo.4
Los factores de riesgo de la anestesia incluyen los siguientes, descriptos en el cuadro a continuación.
La evaluación del riesgo quirúrgico y el monitoreo perioperatorio son componentes fundamentales de un plan quirúrgico personalizado, y pueden reducir el riesgo de resultados adversos de la cirugía y de muerte en pacientes con MPS.4,10,11
Consideraciones de cirugía ortopédica en MPS13
Consideraciones
MPS III/IV/VI
References: 1. McGill JJ, Inwood AC, Coman DJ, et al. Enzyme replacement therapy for mucopolysaccharidosis VI from 8 weeks of age—a sibling control study. Clin Genet. 2010;77(5):492-498. doi:10.1111/j.1399-0004.2009.01324.x. 2. Furujo M, Kubo T, Kosuga M, Okuyama T. Enzyme replacement therapy attenuates disease progression in two Japanese siblings with mucopolysaccharidosis type VI. Mol Genet Metab. 2011;104(4):597-602. doi:10.1016/j.ymgme.2011.08.029. 3. Clarke LA. Pathogenesis of skeletal and connective tissue involvement in the mucopolysaccharidoses: glycosaminoglycan storage is merely the instigator. Rheumatology (Oxford). 2011;50(suppl 5):v13-18. 4. Lehman TJA, Miller N, Norquist B, Underhill L, Keutzer J. Diagnosis of the mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v41-v48. 5. Morishita K, Petty RE. Musculoskeletal manifestations of mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v19-v25. doi:10.1093/rheumatology/ker397. 6. Muenzer J, Beck M, Eng CM, et al. Long-term, open-labeled extension study of idursulfase in the treatment of Hunter syndrome. Genet Med. 2011;13(2):95-101. doi:10.1097/GIM.0b013e3181fea459. 7. Hendriksz C. Improved diagnostic procedures in attenuated mucopolysaccharidosis. Br J Hosp Med. 2011;72(2):91-95. 8. Muenzer J. Early initiation of enzyme replacement therapy for the mucopolysaccharidoses. Mol Genet Metab. 2014;111(2):63-72. doi:10.1016/j.ymgme.2013.11.015. 9. Hendriksz CJ, Berger KI, Giugliani R, et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1-15. doi:10.1002/ajmg.a.36833. 10. Bagewadi S, Roberts J, Mercer J, Jones S, Stephenson J, Wraith JE. Home treatment with Elaprase® and Naglazyme® is safe in patients with mucopolysaccharidoses types II and VI, respectively. J Inherit Metab Dis. 2008;31(6):733-737. doi:10.1007/s10545-008-0980-0. 11. BioMarin Pharmaceutical Inc. VIMIZIM website. http://www.vimizim.com/. Accessed December 21, 2015. 12. BioMarin Pharmaceutical Inc. NAGLAZYME website. http://www.naglazyme.com/. Accessed December 21, 2015. 13. Muenzer J, Wraith JE, Clarke LA, International Consensus Panel on the Management and Treatment of Mucopolysaccharidosis I. Mucopolysaccharidosis I: management and treatment guidelines. Pediatrics. 2009;123(1):19-29. doi:10.1542/peds.2008-0416.
References: 1. Agency for Healthcare Research and Quality. Defining the PCMH. https://pcmh.ahrq.gov/page/defining-pcmh. Accessed December 15, 2015. 2. Muenzer J. The mucopolysaccharidoses: a heterogeneous group of disorders with variable pediatric presentations. J Pediatr. 2004;144(suppl 5):S27-S34. 3. Hendriksz CJ, Berger KI, Giugliani R, et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1-15. doi:10.1002/ajmg.a.36833. 4. White KK. Orthopaedic aspects of mucopolysaccharidoses. Rheumatology (Oxford). 2011;50(suppl 5):v26-v33. doi:10.1093/rheumatology/ker393. 5. Walker R, Belani KG, Braunlin EA, et al. Anaesthesia and airway management in mucopolysaccharidosis. J Inherit Metab Dis. 2013;36(2):211-219. doi:10.1007/s10545-012-9563-1. 6. Harmatz P, Mengel KE, Giugliani R, et al. The Morquio A clinical assessment program: baseline results illustrating progressive, multisystemic clinical impairments in Morquio A subjects. Mol Genet Metab. 2013;109(1):54-61. doi:10.1016/j.ymgme.2013.01.021. 7. Muenzer J, Wraith JE, Clarke LA, International Consensus Panel on the Management and Treatment of Mucopolysaccharidosis I. Mucopolysaccharidosis I: management and treatment guidelines. Pediatrics. 2009;123(1):19-29. doi:10.1542/peds.2008-0416. 8. Morishita K, Petty RE. Musculoskeletal manifestations of mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v19-v25. doi:10.1093/rheumatology/ker397. 9. Hendriksz C. Improved diagnostic procedures in attenuated mucopolysaccharidosis. Br J Hosp Med. 2011;72(2):91-95. 10. White KK, Sousa T. Mucopolysaccharide disorders in orthopaedic surgery. J Am Acad Orthop Surg. 2013;21:12-22. doi:10.5435/JAAOS-21-01-12. 11. Valayannopoulos V, Wijburg FA. Therapy for the mucopolysaccharidoses. Rheumatology (Oxford). 2011;50 Suppl 5:v49-59. doi:10.1093/rheumatology/ker396. 12. Solanki GA, Martin KW, Theroux MC, et al. Spinal involvement in mucopolysaccharidosis IVA (Morquio-Brailsford or Morquio A syndrome): presentation, diagnosis and management. J Inherit Metab Dis. 2013;36(2):339-355. doi:10.1007/s10545-013-9586-2. 13. Spinello CM, Novello LM, Pitino S, et al. Anesthetic management in mucopolysaccharidoses. ISRN Anesthesiol. 2013;2013:1-10. doi:10.1155/2013/791983. 14. Neufeld EF, Muenzer J. In: Valle D, Beaudet AL, Vogelstein B, Kinzler KW, et al, eds. The Metabolic and Molecular Bases of Inherited Disease. 8th ed. New York, NY: McGraw-Hill; 2001:3421-3452. 15. Scarpa M, Almassy Z, Beck M, et al. Mucopolysaccharidosis type II: European recommendations for the diagnosis and multidisciplinary management of a rare disease. Orphanet J Rare Dis. 2011;6:72. doi:10.1186/1750-1172-6-72. 16. James A, Hendriksz CJ, Addison O. The oral health needs of children, adolescents and young adults affected by a mucopolysaccharide disorder. JIMD Rep. 2012;2:51-58. doi:10.1007/8904_2011_46. 17. Coutinho MF, Lacerda L, Alves S. Glycosaminoglycan storage disorders: a review. Biochem Res Int. 2012;2012:471325. doi:10.1155/2012/471325. 18. Kakkis ED, Neufeld EF. The mucopolysaccharidoses. In: Berg BO, ed. Principles of child neurology. New York, NY: McGraw-Hill; 1996:1141-1166. 19. Lehman TJA, Miller N, Norquist B, Underhill L, Keutzer J. Diagnosis of the mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v41-v48.
References: 1. Hendriksz CJ, Berger KI, Giugliani R, et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1-15. doi:10.1002/ajmg.a.36833. 2. Muenzer J, Beck M, Eng CM, et al. Long-term, open-labeled extension study of idursulfase in the treatment of Hunter syndrome. Genet Med. 2011;13(2):95-101. doi:10.1097/GIM.0b013e3181fea459. 3. Harmatz P, Mengel KE, Giugliani R, et al. The Morquio A clinical assessment program: baseline results illustrating progressive, multisystemic clinical impairments in Morquio A subjects. Mol Genet Metab. 2013;109(1):54-61. doi:10.1016/j.ymgme.2013.01.021. 4. Walker R, Belani KG, Braunlin EA, et al. Anaesthesia and airway management in mucopolysaccharidosis. J Inherit Metab Dis. 2013;36(2):211-219. doi:10.1007/s10545-012-9563-1. 5. Lavery C, Hendriksz C. Mortality in patients with Morquio syndrome A. J Inherit Metab Dis Rep. 2015;15:59-66. doi:10.1007/8904_2014_298. 6. Theroux MC, Nerker T, Ditro C, Mackenzie WG. Anesthetic care and perioperative complications of children with Morquio syndrome. Paediatr Anaesth. 2012;22(9):901-907. doi:10.1111/j.1460-9592.2012.03904.x. 7. Muenzer J. The mucopolysaccharidoses: a heterogeneous group of disorders with variable pediatric presentations. J Pediatr. 2004;144(suppl 5):S27-S34. 8. Scarpa M, Almassy Z, Beck M, et al. Mucopolysaccharidosis type II: European recommendations for the diagnosis and multidisciplinary management of a rare disease. Orphanet J Rare Dis. 2011;6:72. doi:10.1186/1750-1172-6-72. 9. Valayannopoulos V, Wijburg FA. Therapy for the mucopolysaccharidoses. Rheumatology (Oxford). 2011;50 Suppl 5:v49-59. doi:10.1093/rheumatology/ker396. 10. Solanki GA, Martin KW, Theroux MC, et al. Spinal involvement in mucopolysaccharidosis IVA (Morquio-Brailsford or Morquio A syndrome): presentation, diagnosis and management. J Inherit Metab Dis. 2013;36(2):339-355. doi:10.1007/s10545-013-9586-2. 11. Vitale MG, Skaggs DL, Pace GI, et al. Delphi Consensus Report: Best practices in intraoperative neuromonitoring in spine deformity surgery: development of an intraoperative checklist to optimize response. Spine Deformity. 2014;2(5):333-339. doi:10.1016/j.jspd.2014.05.003. 12. Solanki GA, Alden TD, Burton BK, et al. A multinational, multidisciplinary consensus for the diagnosis and management of spinal cord compression among patients with mucopolysaccharidosis VI. Mol Genet Metab. 2012;107:15-24. doi:10.1016/j.ymgme.2012.07.018. 13. Spinello CM, Novello LM, Pitino S, et al. Anesthetic management in mucopolysaccharidoses. ISRN Anesthesiol. 2013;2013:1-10. doi:10.1155/2013/791983. 14. White KK, Sousa T. Mucopolysaccharide disorders in orthopaedic surgery. J Am Acad Orthop Surg. 2013;21:12-22. doi:10.5435/JAAOS-21-01-12.